En 1905, Albert Einstein publica el trabajo sobre el efecto fotoeléctrico.
Con este trabajo, da significado físico a la hipótesis de la cuantización de
la energía. A Planck no se le ocurrió suponer que también la radiación
electromagnética tenía carácter discreto (en vez de continuo).
 |
Einstein sugirió que
la luz está formada de cuantos
discretos de energía (fotones) lo que explicaría fenómenos que la
teoría ondulatoria de la luz todavía no podía explicar, como la fluorescencia
y el efecto fotoeléctrico. Esta conjetura fue confirmada en comprobaciones
posteriores.
Sin embargo, se presentaba una contradicción. Por un lado existían fenómenos,
como la interferencia y la difracción, que se explicaban solamente con la teoría
ondulatoria, mientras que otros fenómenos, como el efecto fotoeléctrico, sólo se podían explicar suponiendo que la luz estaba compuesta de corpúsculos.
¿Qué es la luz, onda o partícula?
En 1909, Einstein encontró que las fluctuaciones de la radiación son la
suma de un término correspondiente a las fluctuaciones de ondas y de otro que
corresponde a las fluctuaciones de partículas. Es decir, ¡la luz se comporta al
mismo tiempo como si fuera onda y partícula! Existe una dualidad onda-corpúsculo. |
El
experimento del prisma de Newton se convirtió en el espectroscopio, aparato que
utilizando el prisma descompone la luz emitida por cualquier sustancia al
calentarse. Así se descubrió que la luz que emite cada sustancia no forma un
continuo de colores, sino que solamente aparecen algunos. Esto no podía explicarlo la
física clásica.
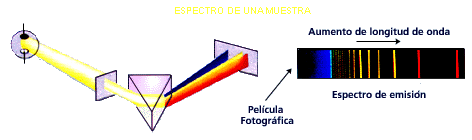
Este
espectro caracteriza a la sustancia, es como su firma. Así, en el sodio
destaca una franja amarilla. Esto nos permite saber, por ejemplo, de qué están
hechas las estrellas.
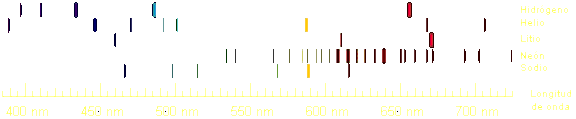
|

|
En 1913, usando conceptos cuánticos, Bohr publica su trabajo sobre la
estructura del átomo de hidrógeno. Se basó en que el momento angular del
electrón solamente puede tener valores iguales a múltiplos de la constante de
Planck. Einstein se refirió a este trabajo como uno de los más grandes
descubrimientos. |
Posteriormente, se desarrolló
toda una teoría sobre la estructura atómica y los espectros correspondientes.
|

|
En
1924, Louis de Broglie y Einstein llegan a la idea de que no sólo la luz, sino
toda materia, debe tener un comportamiento dual (partículas y ondas). [Louis de
Broglie propone hacer un experimento que compruebe esta teoría a un colaborador
de su hermano, pero este estaba demasiado ocupado
experimentando con televisión.] Einstein trabaja sobre esta idea y
llega a la misma conclusión. |
|

|
En 1925
Heisenberg rechaza las nociones clásicas de posición y velocidad de un
electrón, ya que no se habían medido directamente. Propone, en su lugar,
trabajar con frecuencias e intensidades, que sí son medibles directamente. Con
ayuda del cálculo matemático de matrices, desarrolla una teoría sobre
mecánica cuántica llamada teoría matricial. |
|

|
En
1926, Schrödinger desarrolla la teoría ondulatoria de la mecánica cuántica.
Ese mismo año, se demuestra que las dos teorías de la mecánica cuántica, la
ondulatoria y la matricial, son equivalentes.
En
1927 se demuestra experimentalmente que los electrones, considerados hasta
entonces como partículas, también tienen un comportamiento ondulatorio. |
Aunque
la mecánica cuántica describe el átomo exclusivamente a través de
interpretaciones matemáticas de los fenómenos observados, puede decirse a
grandes rasgos que en la actualidad se considera que el átomo está formado por
un núcleo rodeado por una serie de ondas estacionarias; estas ondas tienen
máximos en puntos determinados, y cada onda estacionaria representa una
órbita. El cuadrado de la amplitud de la onda en cada punto en un momento dado
es una medida de la probabilidad de que un electrón se encuentre allí. Ya no
puede decirse que un electrón esté en un punto determinado en un momento dado
(principio de incertidumbre de Heisenberg).
La mecánica cuántica se ha revelado como la herramienta más
poderosa para entender y predecir toda clase de fenómenos físicos y está en
la base de los desarrollos tecnológicos de mayor éxito en la segunda mitad del
siglo XX. Al ser aplicada a átomos y moléculas, la mecánica cuántica es la
base y el futuro de la química moderna, pues permite dar un fundamento riguroso al enlace químico. Parece apropiado identificar el siglo XX como
el siglo cuántico. La mecánica cuántica formulada por Heisenberg, Schrödinger y otros
es la que actualmente se utiliza para la solución de un gran número de
problemas físicos, químicos y hasta biológicos.






